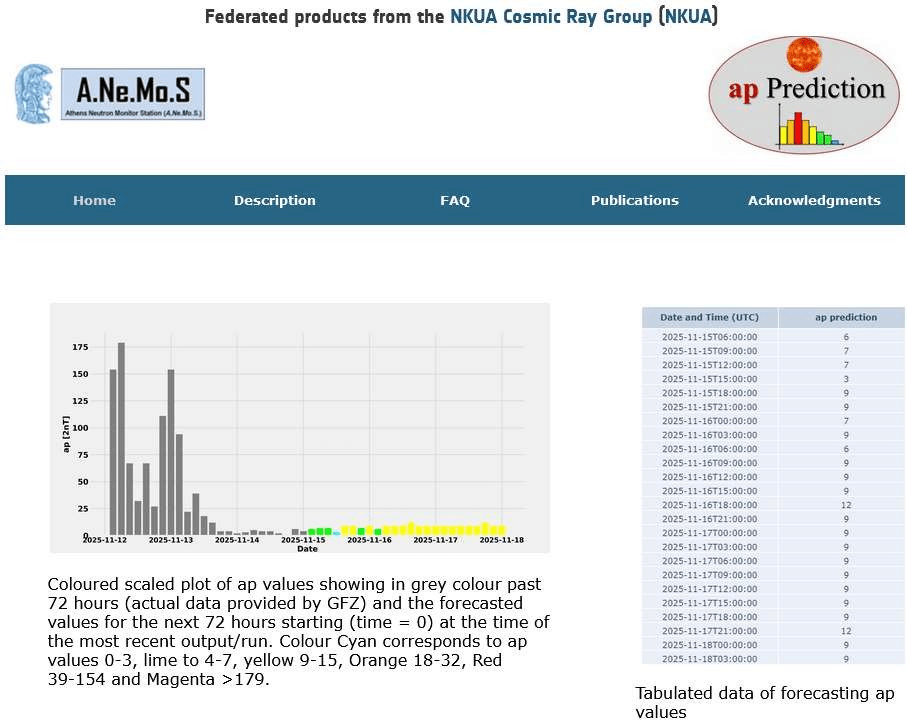
H αμινοπεπτιδάση του ενδοπλασματικού δικτύου 1 (ERAP1) είναι ένα ένζυμο που αποτελεί κεντρικό ρυθμιστή της παραγωγής αντιγονικών επιτόπων και γενικότερα της επίκτητης ανοσοαπόκρισης. Συγκεκριμένα, η ERAP1 ρυθμίζει το μήκος και τη φύση των αντιγονικών πεπτιδίων που παρουσιάζονται από τα μόρια του μείζονος συμπλέγματος ιστοσυμβατότητας I (MHC-I), ενεργοποιώντας με αυτόν τον τρόπο τη δράση των T λεμφοκυττάρων κατά των λοιμώξεων και των νεοπλασιών. Πολυμορφισμοί της ERAP1 διαφοροποιούν τους αντιγονικούς επιτόπους που παρουσιάζεται από τα MHC-Ι και έχουν συσχετιστεί με προδιάθεση σε αυτοάνοσες ασθένειες και στον καρκίνο. Για τους παραπάνω λόγους, ένα πλήθος πρόσφατων ερευνητικών εργασιών αναδεικνύουν την ERAP-1 ως θεραπευτικό στόχο για την ανοσοθεραπεία του καρκίνου αλλά και την αντιμετώπιση της αυτοανοσίας και καθιστούν επιτακτική τη μελέτη του μοριακού μηχανισμού δράσης της ώστε να αναπτυχθούν μικρά μόρια ικανά είτε να αναστέλλουν είτε να ενισχύουν τη δραστικότητά της.
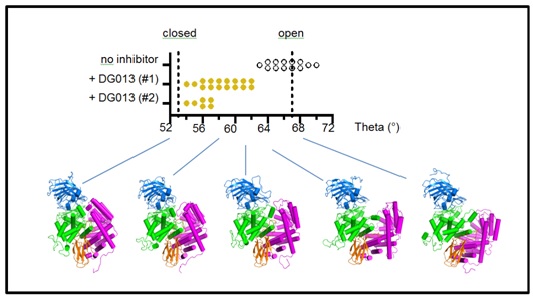
Στο πλαίσιο αυτό εξελίχθηκε η συνεργασία του Εργαστηρίου Βιοχημείας (Αναπληρωτής Καθηγητής Ευστράτιος Στρατίκος) και του Εργαστηρίου Οργανικής Χημείας (Καθηγητής Δημήτριος Γεωργιάδης) του Τμήματος Χημείας του ΕΚΠΑ και του Τμήματος Παθολογίας της Ιατρικής Σχολής του Πανεπιστημίου της Μασαχουσέτης (Lawrence J. Stern, συντονιστής έρευνας). Οι ερευνητές εκτέλεσαν μια λεπτομερή μελέτη σχετικά με τα δομικά χαρακτηριστικά της ERAP1 που καθορίζουν την εξειδίκευσή της και την καταλυτική της λειτουργία. Συγκεκριμένα, εξετάστηκαν οι διαμορφωτικές καταστάσεις της ERAP1 με χρήση σκέδασης ακτίνων Χ μικρής γωνίας (SAXS) και παρατηρήθηκε ότι η ERAP1 υιοθετεί μια ανοιχτή διαμόρφωση σε διάλυμα η οποία κλείνει παρουσία υποστρωμάτων, αναστολέων ή ακόμα και ενός αλλοστερικού ενεργοποιητή. Η σταθερότητα της κλειστής διαμόρφωσης μεταβάλλεται στην περίπτωση πολύμορφων που σχετίζονται με ασθένειες, όπως διαπιστώθηκε στην περίπτωση του K528R όπου αλλαγές στις ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των δομικών περιοχών επηρεάζουν την καταλυτική δράση. Με χρήση αναστολέων φωσφινικού τύπου αποδείχτηκε ότι δομικές μεταβολές στο ενεργό κέντρο του ενζύμου συνοδεύονται από διαμορφωτικές κινήσεις μεγάλων δομικών τμημάτων του ενζύμου. Επίσης, ένας ειδικά σχεδιασμένος φωσφινικός αναστολέας ικανός να προσδένεται ομοιοπολικά με την πρωτεΐνη έπειτα από ακτινοβόληση αποκάλυψε τις θέσεις πρόσδεσης του C-τελικού άκρου των υποστρωμάτων και βοήθησε στη μελέτη των ενεργειακών παραμέτρων που διέπουν το «κλείσιμο» του ενζύμου. Τα αποτελέσματα αυτά δείχνουν ότι η πρόσδεση μεγάλων πεπτιδικών υποστρωμάτων στην ERAP1 πυροδοτεί μια σειρά εκτεταμένων διαμορφωτικών μεταβολών που οδηγούν στην αναδιοργάνωση του ενεργού κέντρου της και την εκδήλωση της καταλυτικής δράσης. Οι πληροφορίες αυτές ανοίγουν νέους δρόμους για την χειραγώγηση της δραστικότητας αυτού του ενζύμου για θεραπευτικές εφαρμογές στην ανοσοθεραπεία του καρκίνου και την ρύθμιση της φλεγμονής αυτοάνοσης αιτιολογίας
Maben, Z., Arya, R., Georgiadis, D., Stratikos, Ε., Stern L.J. “Conformational dynamics linked to domain closure and substrate binding explain the ERAP1 allosteric regulation mechanism.” Nature Communications, 12, 5302 (2021).
Για πρόσβαση στο πλήρες κείμενο της εργασίας, επισκεφτείτε τον ιστότοπο: https://www.nature.com/articles/s41467-021-25564-w
Για περισσότερες πληροφορίες σχετικά με την εργασία, επικοινωνήστε με τον Αναπλ. Καθηγητή Ευστράτιο Στρατίκο (estratikos@chem.uoa.gr, http://users.uoa.gr/~estratikos/) και τον Καθηγητή Δημήτριο Γεωργιάδη (dgeorgia@chem.uoa.gr, http://users.uoa.gr/~dgeorgia/).